La spectrométrie d’absorption atomique (SAA) est une technique analytique de référence pour la détermination quantitative des éléments métalliques dans une grande variété d’échantillons. Basée sur l’absorption de la lumière par des atomes libres à l’état fondamental, elle permet de mesurer des concentrations extrêmement faibles avec une précision remarquable. Utilisée dans des domaines aussi variés que l’agroalimentaire, l’environnement, la pharmaceutique ou encore les matériaux, la SAA joue un rôle clé dans le contrôle qualité, la conformité réglementaire et la recherche scientifique. Cet article explore les principes fondamentaux de cette méthode, son fonctionnement, ses principales applications ainsi que ses avantages analytiques.
Table des matières
Principe de la spectrométrie d’absorption atomique
Une méthode optique fondée sur l’absorption atomique
La spectrométrie d’absorption atomique est une méthode d’analyse élémentaire basée sur un phénomène physique simple : l’absorption d’un rayonnement lumineux par des atomes à l’état fondamental. Contrairement à d’autres techniques spectroscopiques reposant sur l’émission de lumière, la SAA mesure la quantité de lumière absorbée par un atome donné lorsque celui-ci est exposé à une source de rayonnement électromagnétique monochromatique, émise à la longueur d’onde caractéristique de l’élément analysé.
Lorsqu’un faisceau lumineux traverse un nuage d’atomes vaporisés, une partie de ce rayonnement est absorbée si sa longueur d’onde correspond à l’énergie nécessaire pour exciter les électrons de ces atomes. Cette perte d’intensité lumineuse, mesurée avant (I₀) et après (Iₜ) le passage dans le milieu atomique, est directement liée à la concentration de l’élément cible dans l’échantillon.
La loi de Beer-Lambert au cœur de la quantification
La relation mathématique entre l’absorbance et la concentration repose sur la loi de Beer-Lambert, formulée comme suit :
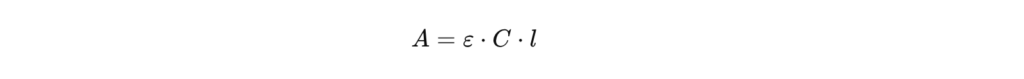
où :
- A est l’absorbance,
- ε est le coefficient d’extinction molaire,
- l est la longueur de la cuve,
- c est la concentration de la solution.
Cette loi linéaire est applicable dans une gamme de concentrations bien définie. Lorsque la concentration est trop élevée ou que des interférences sont présentes, des écarts à la linéarité peuvent apparaître, nécessitant des corrections instrumentales ou une dilution de l’échantillon.
De Kirchhoff à la SAA moderne : une évolution technologique continue
Le concept d’absorption atomique remonte aux expériences fondamentales de Gustav Kirchhoff au XIXe siècle. Il démontra que les raies sombres observées dans un spectre d’absorption coïncidaient avec les raies brillantes du spectre d’émission des éléments chauffés dans une flamme. Ces observations ont jeté les bases de la spectroscopie atomique moderne.
La véritable révolution de la SAA eut lieu dans les années 1950 grâce aux travaux du physicien australien Alan Walsh, qui introduisit le principe de l’absorption atomique avec des sources lumineuses spécifiques à chaque élément. Cette approche permit une analyse plus précise et reproductible, en particulier pour les éléments métalliques.
Depuis, la SAA a connu de nombreuses améliorations technologiques : sources lumineuses plus stables, systèmes de correction du fond (comme l’effet Zeeman), dispositifs d’atomisation optimisés (flamme, four graphite, générateur d’hydrures), automatisation des analyses, et intégration de logiciels de traitement des données. Ces évolutions ont élargi le champ d’application de la SAA tout en augmentant la sensibilité, la fiabilité et la productivité de cette technique.
Aujourd’hui, la spectrométrie d’absorption atomique est considérée comme une méthode de référence pour le dosage des métaux en trace, grâce à sa robustesse, sa spécificité et sa capacité à fournir des résultats quantitatifs reproductibles sur une large variété de matrices.
Appareillage utilisé en spectrométrie d’absorption atomique
Composition d’un spectromètre d’absorption atomique
Un spectromètre d’absorption atomique se compose généralement de six éléments principaux, disposés en série selon le trajet optique :
- Une source de lumière qui émet un rayonnement monochromatique à la longueur d’onde spécifique de l’élément étudié.
- Un modulateur, mécanique ou électronique, qui permet de distinguer la lumière d’analyse du bruit de fond.
- Un atomiseur, chargé de transformer l’échantillon en un nuage d’atomes libres à l’état fondamental.
- Un monochromateur, qui isole la raie d’intérêt en éliminant les longueurs d’onde parasites.
- Un détecteur, généralement un photomultiplicateur, qui mesure l’intensité lumineuse résiduelle.
- Un système de traitement de données, qui convertit le signal lumineux en absorbance, puis en concentration.
Il existe deux architectures instrumentales principales : les spectromètres à simple faisceau et ceux à double faisceau. Dans la version simple faisceau, le rayonnement traverse successivement l’atomiseur puis le monochromateur avant d’atteindre le détecteur. Dans la version double faisceau, un diviseur optique sépare le faisceau en deux voies : l’une traverse l’atomiseur (faisceau d’analyse), l’autre le contourne (faisceau de référence). Les deux signaux sont comparés pour corriger les fluctuations de la source et améliorer la stabilité de la mesure.
Les différentes sources lumineuses utilisées
La qualité de la source lumineuse conditionne la sélectivité et la sensibilité de la mesure. En spectrométrie d’absorption atomique, on utilise principalement des lampes émettant des raies spectrales fines propres à chaque élément.
La lampe à cathode creuse (Hollow Cathode Lamp – HCL) est la plus utilisée. Elle contient une cathode fabriquée dans le métal à analyser, une anode en tungstène, et un gaz inerte (argon ou néon) sous faible pression. Une décharge électrique entre les électrodes provoque l’excitation des atomes de la cathode, qui émettent un spectre de raies caractéristiques lors de leur retour à l’état fondamental.
La lampe à vapeur métallique repose sur le même principe, mais contient directement l’élément sous forme métallique. Elle est adaptée aux métaux facilement volatils comme le sodium ou le mercure.
Enfin, les lampes à décharge sans électrode (Electrodeless Discharge Lamp – EDL) sont utilisées pour les éléments volatils difficiles à analyser par lampe à cathode creuse (arsenic, antimoine, sélénium, bismuth). Elles offrent une meilleure intensité et une durée de vie plus longue.
Le modulateur : gestion du signal d’analyse
Le modulateur permet d’interrompre périodiquement le faisceau lumineux incident pour distinguer le signal utile (lumière absorbée par l’analyte) du bruit de fond (lumière parasite ou émissions de la flamme). Deux types de modulation sont couramment utilisés :
- Modulation mécanique par un hacheur optique, souvent un disque tournant qui bloque et libère cycliquement le faisceau.
- Modulation électrique par alimentation alternative de la lampe. Dans ce cas, le courant alternatif permet de générer un signal périodique plus facile à isoler et à amplifier. Cette méthode facilite aussi la discrimination entre les photons absorbés par l’échantillon et ceux émis par la source.
Le monochromateur : sélection de la raie d’intérêt
Le rôle du monochromateur est de filtrer le rayonnement transmis par l’atomiseur pour ne retenir que la longueur d’onde spécifique à l’élément analysé. Il élimine ainsi les raies du gaz de remplissage, les raies secondaires, ainsi que les émissions parasites issues de la flamme ou du four.
Il est constitué d’une fente d’entrée, d’un système dispersif (prisme ou réseau de diffraction) et d’une fente de sortie. Le réseau décompose le faisceau lumineux en un spectre de longueurs d’onde, et la rotation du dispositif permet de sélectionner avec précision la raie d’analyse.
La bande passante spectrale (typiquement entre 0,2 et 2 nm) doit être choisie de manière à garantir une bonne séparation des raies tout en conservant une intensité suffisante.
Le détecteur : conversion du signal lumineux
Le détecteur le plus couramment utilisé en SAA est le tube photomultiplicateur. Il transforme le signal lumineux transmis par le monochromateur en un signal électrique proportionnel à l’intensité lumineuse reçue. Ce signal est ensuite amplifié, converti, et traité numériquement.
Dans certains instruments récents, on trouve aussi des photodiodes ou des barrettes de diodes, capables de mesurer plusieurs longueurs d’onde simultanément. Ces dispositifs sont toutefois moins répandus en SAA classique, qui reste une méthode monoélémentaire.
Techniques d’atomisation : flamme, four graphite, hydrures, vapeur froide
L’atomisation par flamme : la méthode la plus répandue
La méthode la plus ancienne et la plus couramment utilisée est l’atomisation par flamme, également appelée SAA-flamme. Elle repose sur la pulvérisation de la solution à analyser sous forme d’un aérosol très fin, qui est ensuite introduit dans une flamme issue d’un mélange combustible/comburant.
Les flammes les plus utilisées sont :
- Air/acétylène : température autour de 2300 à 2500 °C
- Protoxyde d’azote/acétylène : jusqu’à 2900 °C, utilisé pour les éléments réfractaires
Deux types de brûleurs existent :
- Le brûleur à flamme laminaire (à prémélange), qui assure une meilleure stabilité de la flamme et donc une plus grande reproductibilité des mesures.
- Le brûleur à flamme turbulente (à diffusion), utilisé dans des contextes spécifiques où la sécurité liée aux gaz est un enjeu.
Dans cette configuration, le nébuliseur transforme la solution liquide en un brouillard d’aérosol, dont seule une petite fraction atteint la flamme. Les gouttelettes sont séchées, puis décomposées thermiquement, libérant progressivement les atomes de l’élément à analyser.
Cette technique est rapide, robuste et suffisante pour les éléments présents à des concentrations supérieures au µg/L. Elle est cependant limitée par sa sensibilité et par le fait que l’atomisation se fait en continu, entraînant une perte importante d’échantillon.
L’atomisation électrothermique : le four graphite
Pour des analyses à très faible concentration, la SAA électrothermique (ou SAA-four graphite) est privilégiée. Cette méthode repose sur un tube en graphite dans lequel une petite quantité d’échantillon (5 à 100 µL) est déposée à l’aide d’un micro-injecteur.
Le tube est chauffé par effet Joule selon un programme thermique en trois étapes :
- Séchage : élimination du solvant à basse température (environ 100 °C)
- Décomposition ou pyrolyse : évaporation des composés organiques et des impuretés sans atomisation de l’élément cible
- Atomisation : libération des atomes à haute température (jusqu’à 3000 °C), en atmosphère inerte (argon)
Le four permet de maintenir temporairement les vapeurs atomiques dans un volume confiné, augmentant ainsi la probabilité d’interaction avec le faisceau lumineux et donc la sensibilité de la mesure.
Cette méthode est bien adaptée aux éléments présents à l’état de traces, mais elle nécessite un contrôle rigoureux des températures et du programme thermique, sous peine de pertes analytiques ou de formation d’interférences.
L’atomisation par génération d’hydrures : une solution pour certains éléments volatils
ertains éléments comme l’arsenic (As), le sélénium (Se), l’antimoine (Sb), le bismuth (Bi), ou le plomb (Pb) forment des composés volatils appelés hydrures. Dans ces cas, l’atomisation peut être améliorée par une étape préalable de génération d’hydrures volatils.
Le principe repose sur une réaction chimique entre l’analyte (en solution acide) et un agent réducteur, comme le borohydrure de sodium (NaBH₄). Cette réaction forme des gaz hydrures, qui sont ensuite transportés par un gaz inerte vers une cellule d’atomisation chauffée, où les hydrures sont décomposés thermiquement pour libérer les atomes.
Cette technique présente une excellente sensibilité et une très bonne sélectivité, en particulier pour les éléments qui forment facilement des hydrures. Elle nécessite toutefois un système de génération d’hydrures dédié, souvent installé en amont du spectromètre.
Vous recherchez une analyse ?

Nébulisation et préparation de l’échantillon
Le rôle central du nébuliseur
Le nébuliseur est un composant indispensable du système d’atomisation, en particulier dans le mode flamme. Il a pour fonction de transformer la solution liquide contenant l’analyte en un aérosol très fin composé de microgouttelettes. Ce brouillard est ensuite acheminé dans la flamme, où les étapes de séchage, de décomposition et d’atomisation peuvent se dérouler correctement.
Une nébulisation efficace doit produire des gouttelettes aussi petites et homogènes que possible. En effet, seules les microgouttelettes atteignant la flamme sont susceptibles d’être correctement atomisées. Les gouttelettes trop grosses sont éliminées par les parois du système ou entraînées par le drain. On estime qu’environ 5 à 10 % du volume nébulisé atteint effectivement la zone d’atomisation, ce qui rend l’optimisation du processus essentielle.
Les types de nébuliseurs
Deux grandes familles de nébuliseurs sont utilisées en spectrométrie d’absorption atomique.
Le nébuliseur pneumatique est le plus courant. Il fonctionne sur le principe de l’aspiration de la solution par un jet de gaz (souvent de l’air ou de l’argon) qui crée une dépression à la sortie d’un capillaire. Le liquide est alors projeté à haute vitesse et éclaté en fines gouttelettes. Des systèmes de tri par impact ou hélice permettent d’éliminer les plus grosses particules avant l’entrée dans la flamme.
Le nébuliseur ultrasonique, beaucoup plus rare en SAA, repose sur la vibration d’un cristal de quartz sur lequel la solution s’écoule. Les ondes ultrasonores fragmentent la surface du liquide en aérosol. Ce type de nébuliseur présente un rendement supérieur mais est plus coûteux et plus fragile.
Le choix du nébuliseur dépend de la viscosité de la solution, du débit requis, de la nature de la matrice et des exigences en sensibilité.
La préparation de l’échantillon : supports et précautions
Pour garantir la qualité de l’analyse, l’échantillon doit être préparé dans des conditions contrôlées. Il est généralement minéralisé à l’aide d’acides forts (nitrique, perchlorique, sulfurique) afin de dissoudre les éléments métalliques présents sous forme ionique ou combinée. Cette étape permet également de simplifier la matrice et de limiter les interférences chimiques.
Les solutions obtenues sont ensuite filtrées et transférées dans des flacons propres, inertes et hermétiques, généralement en polypropylène ou en verre borosilicaté. Ces contenants doivent être compatibles avec les métaux à analyser pour éviter toute contamination ou adsorption des analytes sur les parois.
Voici quelques bonnes pratiques à respecter :
- Utiliser exclusivement des contenants dédiés à l’analyse des métaux.
- Vérifier la compatibilité chimique du matériau avec les solutions acides.
- Éviter les contacts prolongés avec l’air pour limiter l’oxydation.
- Préparer les solutions mères et les étalons dans le même type de matrice que l’échantillon.
Le volume d’injection est également un paramètre critique. Dans le mode flamme, l’échantillon est aspiré de manière continue pendant toute la durée de l’analyse. En mode four graphite, en revanche, le volume doit être précisément mesuré (souvent entre 10 et 50 µL), et déposé au centre du tube à l’aide d’un micro-injecteur. L’utilisation de systèmes d’injection automatisés permet de garantir une meilleure reproductibilité et une traçabilité des dosages.
Une attention particulière doit également être portée aux blancs analytiques et aux solutions d’étalonnage. Le blanc permet de vérifier l’absence de contamination du réactif ou des contenants. Les étalons, quant à eux, sont essentiels pour établir la courbe d’étalonnage utilisée dans le calcul des concentrations.
Interférences analytiques et limites de la méthode
Les interférences chimiques
Les interférences chimiques surviennent lorsque des composants de la matrice forment avec l’élément à analyser des composés stables ou peu volatils. Cela peut réduire l’efficacité de l’atomisation et entraîner une sous-estimation de la concentration réelle.
Par exemple, dans les matrices contenant du phosphore, le calcium peut former du phosphate de calcium, difficilement atomisable. De même, certains anions comme les sulfates ou les carbonates peuvent précipiter des métaux lourds sous forme de sels insolubles.
Pour limiter ces effets, plusieurs stratégies sont possibles :
- Ajouter des modificateurs chimiques (complexants, agents de masquage) qui empêchent la formation de composés stables.
- Travailler à des températures d’atomisation plus élevées (notamment en four graphite).
- Optimiser la composition de la flamme (flamme riche ou pauvre) en fonction des réactions attendues.
Les interférences spectrales
Les interférences spectrales correspondent à des absorbances parasites générées par des espèces autres que l’analyte, mais qui absorbent à des longueurs d’onde proches. Ces interférences peuvent également résulter de la diffusion de la lumière par des particules solides ou de la luminescence émise par la flamme ou la matrice.
Elles sont particulièrement problématiques lorsque la raie d’absorption de l’élément est proche de celles d’autres composants présents dans l’échantillon, ou dans les cas d’émissions parasites fortes (flamme chaude, éléments facilement excitables).
Pour les corriger, plusieurs solutions sont mises en œuvre :
- Utilisation d’un monochromateur haute résolution avec une bande passante étroite.
- Mise en place d’un système de correction de fond, par lampe au deutérium ou par effet Zeeman.
- Choix d’une longueur d’onde alternative, si elle existe pour l’élément cible.
Les effets de matrice
Les effets de matrice regroupent l’ensemble des perturbations liées aux propriétés physiques de l’échantillon : viscosité, tension de surface, pression osmotique, conductivité. Ces paramètres influencent la nébulisation, la dispersion dans la flamme, et la répartition des atomes dans le volume d’absorption.
Un échantillon très concentré en sels, par exemple, peut entraîner une cristallisation rapide lors de la nébulisation, ou un dépôt dans le nébuliseur, modifiant la stabilité du signal. Les matrices biologiques riches en protéines ou en lipides peuvent quant à elles interagir avec le tube graphite et fausser les cycles d’atomisation.
Pour limiter les effets de matrice, il est recommandé de :
- Réaliser une dilution adaptée des échantillons sans descendre sous la LQ.
- Utiliser la méthode des ajouts dosés, qui consiste à ajouter une quantité connue d’analyte à l’échantillon pour compenser les effets de la matrice.
- Employer des modificateurs de matrice, comme les sels d’aluminium ou de palladium, qui stabilisent l’analyte dans le tube graphite.
Les limites techniques et analytiques
Malgré ses nombreux atouts, la spectrométrie d’absorption atomique présente certaines limitations intrinsèques :
- Méthode monoélémentaire : Chaque analyse nécessite une lampe spécifique et une calibration propre à l’élément. Il n’est pas possible d’analyser plusieurs éléments simultanément, sauf par alternance.
- Plage dynamique réduite : L’absorbance obéit à une relation linéaire dans une zone restreinte. Au-delà, la réponse devient non linéaire, rendant les résultats imprécis.
- Temps d’analyse : Bien que rapide en mode flamme, la méthode devient plus lente en four graphite ou en génération d’hydrures, en raison des cycles de chauffe et des injections successives.
- Coût et entretien : Le remplacement des lampes, l’entretien du nébuliseur et des systèmes d’injection automatique peuvent générer des coûts non négligeables à long terme.
En dépit de ces contraintes, la SAA reste l’une des techniques les plus robustes et les plus documentées pour le dosage des éléments traces. L’utilisation combinée de dispositifs de correction, de méthodes de préparation adaptées et de bonnes pratiques de laboratoire permet de minimiser l’impact des interférences et d’exploiter pleinement le potentiel analytique de cette méthode.

Domaines d’application de la spectrométrie d’absorption atomique
Surveillance environnementale et analyses réglementaires
La spectrométrie d’absorption atomique est largement utilisée dans le domaine de l’environnement, notamment pour la surveillance de la qualité de l’eau, des sols, des boues, et des effluents industriels.
Elle permet de détecter des métaux toxiques tels que le plomb, le cadmium, l’arsenic, le mercure ou encore le chrome hexavalent dans des concentrations très faibles, souvent inférieures à 1 µg/L. Ces analyses sont encadrées par des normes internationales telles que la directive-cadre sur l’eau (2000/60/CE) ou la norme NF EN ISO 5961 pour le dosage du cadmium.
Dans les laboratoires accrédités, la SAA est utilisée pour :
- Le contrôle de l’eau potable, des eaux de surface et des eaux souterraines
- L’analyse des lixiviats de déchets
- La caractérisation des sols pollués et des sédiments
Sécurité alimentaire et nutraceutique
Dans l’industrie agroalimentaire et la nutraceutique, la SAA est employée pour vérifier la conformité des produits avec les limites maximales de résidus de métaux lourds fixées par les règlements européens.
Elle est utilisée pour doser les éléments indésirables dans :
- Les matières premières agricoles (légumes, céréales, herbes)
- Les produits transformés (jus, compléments alimentaires, poudres nutritionnelles)
- Les emballages alimentaires, en lien avec les tests de migration
Ces analyses permettent d’évaluer la sécurité sanitaire des denrées, de garantir la conformité réglementaire (règlement CE 1881/2006), et de valider les allégations nutritionnelles sur les teneurs en minéraux (fer, zinc, magnésium, calcium…).
Cosmétique et produits de soins
Dans le secteur des cosmétiques, la spectrométrie d’absorption atomique est utilisée pour détecter la présence de contaminants métalliques dans les ingrédients ou les produits finis.
Les métaux indésirables les plus surveillés sont le nickel (Ni), le plomb (Pb), le cadmium (Cd), le mercure (Hg) et l’arsenic (As), en raison de leur potentiel toxique et allergène. Ces substances ne doivent pas être présentes dans les cosmétiques finis, sauf en traces techniquement inévitables.
Les laboratoires analysent également :
- Les pigments et colorants (oxydes de fer, dioxyde de titane…)
- Les produits solaires et crèmes hydratantes
- Les produits capillaires ou de maquillage
La SAA permet ainsi de garantir la sécurité d’usage et la conformité avec le règlement cosmétique (CE 1223/2009).
Santé animale et pharmacie
En santé animale, la SAA est utilisée pour évaluer la teneur en minéraux des aliments pour animaux, et détecter d’éventuelles contaminations par des métaux lourds dans les formulations vétérinaires.
Dans le domaine pharmaceutique, la spectrométrie d’absorption atomique permet de contrôler la pureté des excipients et principes actifs selon les exigences de la directive ICH Q3D sur les impuretés élémentaires. Cette directive impose des seuils stricts pour les éléments classés selon leur toxicité (groupe 1 à 3), et impose une validation rigoureuse des méthodes analytiques.
Les applications incluent :
- Le contrôle des sels minéraux (Ca, Fe, Mg, Zn…) dans les solutions injectables
- Le dosage du plomb, arsenic, mercure et cadmium dans les ingrédients pharmaceutiques
- La vérification des intrants issus de procédés catalytiques (platine, palladium)
Contrôle des matériaux et procédés industriels
La SAA est également utilisée dans les secteurs de la métallurgie, de la chimie des matériaux, et de l’industrie des polymères. Elle permet d’assurer le contrôle qualité des matières premières et des produits finis.
Les analyses peuvent concerner :
- Les alliages métalliques (aluminium, acier, laiton) pour vérifier leur composition
- Les solutions de traitement de surface (bains de galvanoplastie, décapants)
- Les matériaux en contact avec les denrées alimentaires, pour tester les migrations spécifiques
Cette méthode est particulièrement utile dans les laboratoires R&D et les laboratoires de production pour assurer la conformité réglementaire (règlement CE 1935/2004, FDA), optimiser les formulations, ou analyser des défauts de fabrication.
Services d’analyse en spectrométrie d’absorption atomique avec YesWeLab
Une solution centralisée pour toutes vos analyses élémentaires
YesWeLab vous permet d’accéder à une offre complète d’analyses par spectrométrie d’absorption atomique, qu’il s’agisse de dosages ponctuels, de campagnes de suivi environnemental ou de validations de conformité réglementaire.
Grâce à une plateforme digitale intuitive, les industriels peuvent :
- Chercher et sélectionner l’analyse adaptée à leur produit ou leur problématique dans le catalogue YesWeLab
- Commander l’analyse en ligne en quelques clics
- Suivre l’acheminement des échantillons et l’avancement des tests
- Télécharger les résultats directement depuis un espace sécurisé
Ce fonctionnement simplifié permet de gagner un temps précieux et d’assurer une traçabilité complète des opérations.
Des prestations conformes aux normes les plus strictes
Les analyses proposées via YesWeLab sont réalisées au sein de laboratoires accrédités ISO 17025 et, pour certains paramètres, reconnus COFRAC. Les méthodes mises en œuvre sont conformes aux référentiels en vigueur :
- Normes NF EN ISO pour l’eau, les sols, les boues, les denrées alimentaires
- ICH Q3D pour les impuretés élémentaires dans les produits pharmaceutiques
- Règlement (CE) 1881/2006 pour les métaux dans les aliments
- Règlement (CE) 1223/2009 pour les cosmétiques
Les résultats sont délivrés avec une incertitude de mesure maîtrisée, des contrôles qualité intégrés, et des commentaires techniques si nécessaire.



